2光子メゾスコープ

- Subcellular-Level Resolution over a 5 mm x 5 mm Field of View
- High-Speed Functional Imaging Across Several Brain Regions Operating in Concert
Mesoscope
Shown with Objective at -20° Rotation
US Patent 10,295,811 & 10,901,194
With a large field of
view (FOV), our Mesoscope
can simultaneously capture
multiple brain regions;
the black circle represents
a Ø5 mm FOV.*

Please Wait
Click for Details
ランダムアクセス走査
当社のメゾスコープは、お客様が設定した走査パターンに従って視野を横方向および軸方向に移動し、高速で画像を作成します。 各領域間を飛び回ってイメージングし、脳内の複数領域間の統合された神経活動を可視化することができます。
デュアルプレーンイメージング機能のアドオンランダムアクセス型2光子メゾスコープ(2p-RAM)には、軸方向における2つの独立した焦点面を同時にイメージングできるデュアルプレーンイメージングのアドオンをご用意しております。詳細については「構成」タブおよび「用途」タブをご覧ください。 デュアルプレーン2光子メゾスコープによるin vivo カルシウムイメージング: |
特長
- 5 mm x 5 mmの視野内における機能イメージング
- 視野全体または複数の非連続領域を走査するように設定可能
- 顕微鏡ボディは試料周りの回転(±20°)とXYZの精密移動が可能
- 1 mmの移動範囲で高速Z軸視野制御を行うリモート集光ミラー
- 筐体内の広い作業スペースに複数の試料や実験装置を設置可能
- 試料を固定したまま視野を移動可能
- HHMI Janelia Research Campusから認可を取得した技術を使用
- ベッセルビームを使用したボリュームイメージング手法やデュアルプレーン集光モジュールのアドオンも可能です。詳細については「用途」タブをご覧ください。
動作範囲
- 対物レンズの焦点周りを-20°~+20°の角度で回転
- Xの精密移動:50.8 mm
- Yの精密移動:152.4 mm
- Zの精密移動:50.8 mm
- 対物レンズとともにXYZ軸が回転
- リモート集光ミラーにより、走査中に1 mmの範囲で高速の焦点調整が可能
ランダムアクセス型2光子メゾスコープ(2p-RAM、US Patent 10,295,811および10,901,194)は、5 mm x 5 mmの極めて大きな視野を有しながら細胞下レベルの分解能を実現しています。このメゾスコープはHHMI Janelia研究キャンパスのKarel Svoboda氏の研究室と協力して開発・製品化されており、空間的に離れていながら協調して働いている脳内の複数領域のin vivo機能イメージング用として設計されています。視野内において非連続の関心領域(ROI)をイメージングする場合は、ビデオフレームレートレベルでの画像取得が可能です(「用途」タブ参照)。
当社の2p-RAMは、2光子のランダムアクセス走査が可能です(右上の写真参照)。このシステムには、リモート集光ユニットが内蔵されており、焦点面を1 mmの範囲で移動できます。リモート集光ユニットは、ほぼ共役位置に置かれたミラーとレゾナントスキャナから構成される横方向走査ユニットと連携して、測定中に視野を横方向と軸方向に移動できます。 横方向走査ユニットは、5 mm x 5 mmの視野内における励起光の照射領域を約6 msで切り替えることができます。対物レンズの作動距離は2.7 mmまたは5.0 mmで、どちらも励起用としてNA0.6、集光用としてNA1.0という大きなNAを有します。走査用光学系が対応する波長範囲は、GFPおよび赤色蛍光タンパク質を2光子励起させるのに適した900~1070 nmが採用されています。これは当社のTiberius®レーザをはじめとする、多光子顕微鏡用に設計された波長可変Ti:Sapphireレーザにも対応します。
このメゾスコープにはモーションコントロールシステムが組み込まれており、試料を固定したままメゾスコープ本体を動かすことができます。メゾスコープ本体は対物レンズ周りの回転(-20°~+20°)のほか、X、Y、Z方向の移動(それぞれ50.8 mm、152.4 mm、50.8 mm)が可能です。これは、当社のBergamo®シリーズ多光子顕微鏡のXYZが対物レンズとともに回転するのと同様です。多関節式のペリスコープを用いると、動作範囲全体にわたりレーザのアライメントを維持できます。覚醒して動く試料では広い作業スペースが必要となるため、メゾスコープの筐体内には光学ワークステーション上に実験装置を設置するためのスペースが確保されています。
A Large Field of View Two-Photon Mesoscope with Subcellular Resolution for In Vivo Imaging
Sofroniew, N.J., Flickinger, D., King, J., & Svoboda, K.
*当ページに掲載している何枚かの写真はhttps://elifesciences.org/content/
5/e14472/article-dataより抜粋しており、それらはクリエイティブ ・コモンズのライセンスにより使用許諾されています。
| Mesoscope Specifications | ||||
|---|---|---|---|---|
| Scan Path Wavelength Range | 900 - 1070 nm | |||
| Field of View | 5 mm x 5 mm | |||
| Objective | Excitation NAa | 0.6 | ||
| Collection NAa | 1.0 | |||
| Working Distance (Minimum)b | 2.7 mm or 5.0 mm | |||
| Lateral Scan Unit | 12 kHz Resonant Scanner + Virtually Conjugated Galvo Scanner Set | |||
| Scan Speed | Field of View is Divided into 608-µm-Wide Vertical Stripes; Time per Scan Line is 42 µs Scan Speed = 42 µs × Number of Stripes × Number of Scan Lines | |||
| Examples | Low Resolution, Full Field of View: 4.3 Frames per Second at ~9.8 µm/Pixel/Stripe (5 mm × 5 mm Area, 9 Stripes at 512 x 512 Pixels) High Resolution, Multiple Regions of Interestc: 9.5 Frames per Second at ~1.2 µm/Pixel (Four 600 µm × 600 µm Areas, 512 x 512 Pixels) | |||
| Epi-Detection | Two Ultrasensitive GaAsP PMTs | |||
| Range of Motion | ||||
| Objective Rotation | -20° to +20° Around Objective Focus; 0.1° Encoder Resolution | |||
| X | 2" (50.8 mm); 0.5 µm Encoder Resolution | |||
| Y | 6" (152.4 mm); 0.5 µm Encoder Resolution | |||
| Z | Stepper Motor | 2" (50.8 mm), 0.1 µm Encoder Resolution | ||
| Remote Focusing Mirror | 1 mm Travel Range | |||
製品や技術に関してご質問・ご相談がございましたら当社までご連絡ください。
構成:ランダムアクセス型2光子メゾスコープ(2p-RAM)とデュアルプレーンイメージング機能のアドオンされた2p-RAMの比較
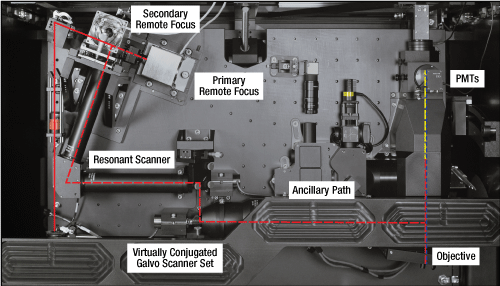
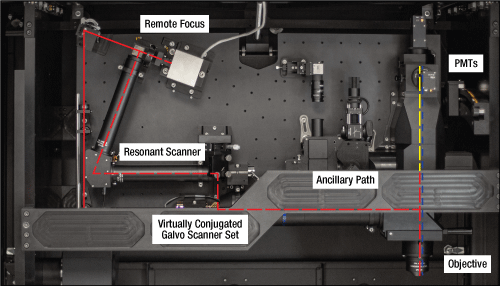
ランダムアクセス型2光子メゾスコープ(2p-RAM、左下)は、焦点面を1 mmの範囲で移動させる集光用リモートミラー、ほぼ共役なミラーとレゾナトスキャナから構成される横方向走査ユニット、動作範囲全体にわたってレーザのアライメントを維持する多関節式ペリスコープ、単一光子イメージングおよび光刺激用の補助的な光路、NAの大きな専用の対物レンズなど、多数の光学システムを内蔵し、それらは全て連携して動作するように最適化されています。デュアルプレーンイメージング機能のアドオンされた2p-RAM(右下)は、同じ光学システムに2つ目のリモート集光モジュールが追加されています。 アドオンについての詳細は「用途」タブをご覧ください。
Click to Enlarge
デュアルプレーンイメージング機能のアドオンされた2p-RAM
用途
カルシウムイメージング
このランダムアクセス型2光子メゾスコープ(2p-RAM)は、HHMI Janelia研究キャンパスのKarel Svoboda氏の研究室と協力して開発・製品化されました。このメゾスコープでカルシウムイメージングを行うと、脳内の複数の領域におけるニューロンの活動を捉えることができます。カルシウムイメージングは、カルシウムインジケータを使用してニューロン集団の活動を追跡するために使用される一般的な手法です。 光の散乱が大きくコントラストが低いワイドフィールド顕微鏡とは異なり、2光子顕微鏡ではin vivoカルシウムイメージングに必要な高解像度とコントラストの向上を実現できます。
thy-1プロモータ(GP 5.17ライン)によってGCaMP6fが発現した大脳皮質の2/3層の低倍率画像と、それに続く高分解能、高フレームレートで取得された4つの視野の画像。(画像ご提供:Nicholas James Sofroniew, Daniel Flickinger, Jonathan King, and Karel Svoboda; Janelia Research Campus and Vidrio Technologies, Virginia, USA.) |
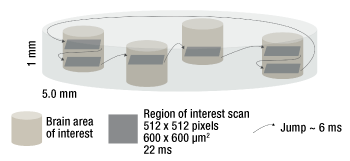
Svoboda氏の研究チームは、2p-RAMを用いて、GCaMP6fカルシウムインジケータを発現する試料のin vivoイメージングを実証しました。右の動画および下の写真のように、多光子メゾスコープでは、視野内における非連続の関心領域(ROI)をビデオフレームレートレベルでイメージングできます。詳細については、research paperをご覧ください。
参照文献: Sofroniew NJ, Flickinger D, King J, and Svoboda K. "A large field of view two-photon mesoscope with subcellular resolution for in vivo imaging." ELife. 2016 Jun. 14; 14472.

Click to Enlarge
このメゾスコープでは、お客様が設定された数の関心領域を1回の走査でトレースすることができます。
(画像ご提供:Karel Svoboda, Janelia Research Campus, Virginia, USA.)
デュアルプレーンイメージング
Karel Svoboda氏の研究室における研究に基づいて、Allen脳科学研究所(Allen Institute for Brain Science)の研究者が多光子メゾスコープに第2の励起光路を追加するためのデュアルプレーン集光アドオンを設計しました。これにより、軸方向における2つの独立した焦点面を同時にイメージングできるようなりました。このモジュールは、設置済みのメゾスコープに対する調整をせずに、システムに追加したり取り外したりできます。Allen脳科学研究所の研究者は、デュアルプレーン集光アドオンを使用した場合と使用しない場合の多光子メゾスコープの比較研究を行い、イメージングスループットが2倍に増加したことを確認しています。下の動画は、デュアルプレーン多光子メゾスコープを使用したin vivoカルシウムイメージングの様子です。Allen脳科学研究所についての詳細は研究所のウェブサイトをご覧ください。
デュアルプレーン集光アドオンについては当社までお問い合わせください。
参照文献: Tsyboulski D, Orlova N, Lecoq J, and Saggau P. "MesoScope Upgrade: Dual Plane Remote Focusing Imaging System for Recording of Ca2+ Signals in Neural Ensembles." Biophotonics Congress: Biomedical Optics Congress 2018 (Microscopy/Translational/Brain/OTS), OSA Technical Digest. 2018; JW3A.60.

Click for Details
リモート集光ユニット
プライマリとセカンダリのリモート集光ユニットは同じ設計になっており、1/4波長板、カスタム仕様の対物レンズ、およびボイスコイルに取り付けられた小型ミラーから構成されています。リモート集光ユニットの前に設置されている偏光ビームスプリッタにより、p偏光はプライマリユニットに、s偏光はセカンダリユニットに向けられます。

Click to Enlarge
デュアルプレーンイメージング機能のアドオン
デュアルプレーンイメージング機能のアドオンでは、オリジナルの2p-RAMシステムにもう1つのリモート集光ユニット(セカンダリユニット)を組み込みます。このユニットは、設置済みのシステムに対する調整をせずに、追加したり取り外したりできます。
Slc17a7-IRES2-Creの興奮性細胞;CaMkII-tTa;一次視覚皮質(V1)およびLateromedial(LM)領域のAi93試料。1プレーンあたりのフレームレート11 Hz、FOV 400 µmでの画像。 | 一次視覚皮質(V1)、Lateromedial (LM)、前外側(AL)、および前内側(AM)領域のVIP抑制細胞。1プレーンあたりのフレームレート11 Hz、FOV 400 µmでの画像。 |
ベッセルビームを使用したボリュームイメージング
Howard Hughes Medical Institute (HHMI)とNa Ji教授(カリフォルニア大学バークレー校)の協力を得て、当社では多光子メゾスコープ用のベッセルビームモジュールをご提供しています。 神経細胞活動のin vivoボリュームイメージングを行うには、サブミクロンの空間分解能とミリ秒の時間分解能の両方が必要です。従来の方法では、回折限界のガウシアンビームを走査して3次元画像を作成しますが、ベッセルビームを用いた多光子イメージングでは、軸方向に細長い集光スポットを利用してボリューム画像を取得します。励起光の被写界深度が拡大されたことにより3次元の体積が2次元に投影され、2次元フレームレートは効率的に3次元ボリュームレートに変換されます。
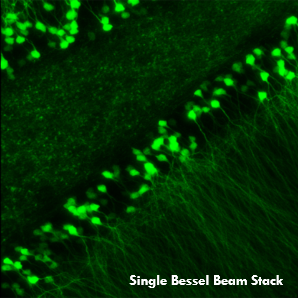
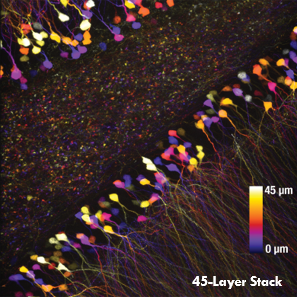
Ji氏の先駆的な研究で実証されたように、このベッセルビームを用いた高速のイメージング技術はシナプス解像度を有し、Ca2+ダイナミクスや、マウスとフェレットの視覚皮質における樹状突起スパインの調整特性などの計測ができます。 下の画像はこのベッセルビームを用いた多光子イメージング技術の能力を示しています。Thy1-GFP-Mマウスの脳切片の300 x 300 μmの範囲を、それぞれベッセルビーム(左)およびガウシアンビーム(右)で走査した画像を比較しています。ガウシアンビームを集光して取得された45枚の光学的なスライス画像を垂直に積み重ねるとボリュームイメージが得られますが、長さ45μmの集光スポットを有するベッセルビームを使用すると、1回走査するだけで同じ構造的な特徴を見ることができます。これはボリュームイメージングの速度が大幅に向上することを示しており、この手法は生体内でまばらにラベル付けされた試料を調べるのに適しています。
ベッセルビームアドオンについての詳細は当社までお問い合わせください。
参照文献: Lu R, Sun W, Liang Y, Kerlin A, Bierfeld J, Seelig JD, Wilson DE, Scholl B, Mohar B, Tanimoto M, Koyama M, Fitzpatrick D, Orger MB, and Ji N. "Video-rate volumetric functional imaging of the brain at synaptic resolution." Nature Neuroscience. 2017 Feb 27; 20: 620-628.
1回のベッセルビームによる走査画像(左)は、ガウシアンビームによる45枚の光学画像の断片を積み重ねて得られた体積走査画像(右)と同じ構造情報を捉えており、これは全走査時間を45分の1に低減できることを示しています。これらの画像は脳切片の300 μm x 300 μmの範囲を走査したものです。ガウシアンビームによる画像を積み重ねた画像の深さはスケールバーで示されています。試料ご提供:Qinrong Zhang, PhD and Matthew Jacobs; the Ji Lab, Department of Physics, University of California, Berkeley.

Click to Enlarge
デモルーム例(中国オフィス)
デモルーム・オンラインデモのご案内
ソーラボの技術者は、世界9カ所のオフィスをベースにしており、お客様の実験用途に適したイメージングシステムをお選びいただくためのお手伝いをいたします。生物学のあらゆる課題解決に向けて研究を行うお客様のために、ニーズに合致し、かつ使いやすく、高い信頼性と対応力のあるシステムを提供いたします。
当社では、実際に当社顕微鏡システムなどを無償でお試しいただけるデモルームをご用意しています。オンラインデモも承ります。 デモルームやオンラインデモのご予約、お問い合わせは当社までご連絡ください。
カスタマーサポート(海外)
(クリックすると詳細がご覧いただけます)
Newton, New Jersey, USA
Thorlabs Headquarters
43 Sparta Avenue
Newton, NJ 07860
Customer Support
- Phone: (973) 300-3000
- E-mail: techsupport@thorlabs.com
Ely, United Kingdom
Thorlabs Ltd.
1 Saint Thomas Place, Ely
Ely CB7 4EX
Customer Support
- Phone: +44 (0)1353-654440
- E-mail: techsupport.uk@thorlabs.com
Bergkirchen, Germany
Thorlabs GmbH
Münchner Weg 1
85232 Bergkirchen
Customer Support
- Phone: +49 (0) 8131-5956-0
- E-mail: europe@thorlabs.com
Maisons-Laffitte, France
Thorlabs SAS
109, rue des Cotes
Maisons-Laffitte 78600
Customer Support
- Phone: +33 (0)970 440 844
- E-mail: techsupport.fr@thorlabs.com
São Carlos, SP, Brazil
Thorlabs Vendas de Fotônicos Ltda.
Rua Rosalino Bellini, 175
Jardim Santa Paula
São Carlos, SP, 13564-050
Customer Support
- Phone: +55-16-3413 7062
- E-mail: brasil@thorlabs.com
デモルームのご案内
(クリックすると詳細がご覧いただけます)
日本 (東京都練馬区)
ソーラボジャパン株式会社
東京都練馬区北町3-6-3
お問い合わせ
- Tel: 03-6915-7701
- Email: techsupport.jp@thorlabs.com
デモルーム常設顕微鏡システム *ほかのデモをご希望の場合もご相談ください。
Sterling, Virginia, USA
Thorlabs Imaging Systems HQ
108 Powers Court
Sterling, VA 20166
Customer Support
- Phone: (703) 651-1700
- E-mail: ImagingTechSupport@thorlabs.com
Demo Rooms
- Bergamo® II Series Multiphoton Microscopes
- Veneto® Inverted Microscopes
- Four-Channel Cerna®-Based Confocal Microscopes
- Cerna Birefringence Imaging Microscopes
- Multiphoton Mesoscope
- OCT Systems: Telesto® and Ganymede™
Lübeck, Germany
Thorlabs GmbH
Maria-Goeppert-Straße 9
23562 Lübeck
Customer Support
- Phone: +49 (0) 8131-5956-40840
- Email: oct@thorlabs.com
Demo Rooms
- Ganymede™ Series SD-OCT Systems
- Telesto® Series SD-OCT Systems
- Telesto® Series PS-OCT Systems
- Atria® Series SS-OCT Systems
- Vega™ Series SS-OCT Systems
Shanghai, China
Thorlabs China
Room A101, No. 100, Lane 2891, South Qilianshan Road
Shanghai 200331
Customer Support
- Phone: +86 (0)21-60561122
- Email: techsupport-cn@thorlabs.com
Demo Rooms
- Bergamo® II Series Multiphoton Microscopes
- Cerna Birefringence Imaging Microscopes
- OCT Systems: Telesto® and Ganymede™
Selected Publications Using Thorlabs' Mesoscope
2024
Manley, J., Demas, J., Kim, H., Martinez Traub, F., & Vaziri, A. (2024). Simultaneous, cortex-wide and cellular-resolution neuronal population dynamics reveal an unbounded scaling of dimensionality with neuron number. bioRxiv, 2024-01.
2023
Ling, D., Moss, E. H., Smith, C. L., Kroeger, R., Reimer, J., Raman, B., & Arenkiel, B. R. (2023). Conserved neural dynamics and computations across species in olfaction. bioRxiv, 2023-02.
Marmor, O., Pollak, Y., Doron, C., Helmchen, F., & Gilad, A. (2023). History information emerges in the cortex during learning. eLife, 12, e83702.
Vickers, E. D., & McCormick, D. A. (2023). Pan-cortical 2-photon mesoscopic imaging and neurobehavioral alignment in awake, behaving mice. bioRxiv, 2023-10.
Chia, X. W., Tan, J. K., Ang, L. F., Kamigaki, T., & Makino, H. (2023). Emergence of cortical network motifs for short-term memory during learning. Nature Communications, 14(1), 6869.
Shin, H., Ogando, M. B., Abdeladim, L., Durand, S., Belski, H., Cabasco, H., & Adesnik, H. (2023). Recurrent pattern completion drives the neocortical representation of sensory inference. bioRxiv, 2023-06.
Capek, E., Ribeiro, T. L., Kells, P., Srinivasan, K., Miller, S. R., Geist, E., & Plenz, D. (2023). Parabolic avalanche scaling in the synchronization of cortical cell assemblies. Nature Communications, 14(1), 2555.
Abdeladim, L., Shin, H., Jagadisan, U., Ogando, M. B., & Adesnik, H. (2023). Probing inter-areal computations with a cellular resolution two-photon holographic mesoscope. bioRxiv, 2023-03.
Makino, H. (2023). Arithmetic value representation for hierarchical behavior composition. Nature Neuroscience, 26(1), 140–149.
Collins, L., Francis, J., Emanuel, B., & McCormick, D. A. (2023). Cholinergic and noradrenergic axonal activity contains a behavioral-state signal that is coordinated across the dorsal cortex. eLife, 12, e81826.
2022
Suhaimi, A., Lim, A. W., Chia, X. W., Li, C., & Makino, H. (2022). Representation learning in the artificial and biological neural networks underlying sensorimotor integration. Science Advances, 8(22), eabn0984.
Yadav, N., Noble, C., Niemeyer, J. E., Terceros, A., Victor, J., Liston, C., & Rajasethupathy, P. (2022). Prefrontal feature representations drive memory recall. Nature, 608(7921), 153-160.
Kanamori, T., & Mrsic-Flogel, T. D. (2022). Independent response modulation of visual cortical neurons by attentional and behavioral states. Neuron, 110(23), 3907-3918.
Liu, J., Li, Y., Lyu, L., Xiao, L., Memon, A. A., Yu, X., ... & Siedlecki, A. (2022). Integrin α5 Is regulated by miR-218-5p in endothelial progenitor cells. Journal of the American Society of Nephrology, 33(3), 565-582.
Takado, Y., Takuwa, H., Sampei, K., Urushihata, T., Takahashi, M., Shimojo, M., ... & Higuchi, M. (2022). MRS-measured glutamate versus GABA reflects excitatory versus inhibitory neural activities in awake mice. Journal of Cerebral Blood Flow & Metabolism, 42(1), 197-212.
2021
Collins, L., Boddington, L., Steffan, P. J., & McCormick, D. (2021). Vagus nerve stimulation induces widespread cortical and behavioral activation. Current Biology, 31(10), 2088-2098.
Demas, J., Manley, J., Tejera, F., Kim, H., Martínez Traub, F., Chen, B., & Vaziri, A. (2021). High-speed, cortex-wide volumetric recording of neuroactivity at cellular resolution using light beads microscopy. Nature Methods, 18(9), 1103-1111.
Nagai, J., Bellafard, A., Qu, Z., Yu, X., Ollivier, M., Gangwani, M. R., ... & Khakh, B. S. (2021). Specific and behaviorally consequential astrocyte Gq GPCR signaling attenuation in vivo with iβARK. Neuron. 109(14), 2256-2274.
Sato, H., Takado, Y., Toyoda, S., Tsukamoto-Yasui, M., Minatohara, K., Takuwa, H., ... & Higuchi, M. (2021). Neurodegenerative processes accelerated by protein malnutrition and decelerated by essential amino acids in a tauopathy mouse model. Science Advances, 7(43), eabd5046.
Kubota, M., Kimura, Y., Shimojo, M., Takado, Y., Duarte, J. M., Takuwa, H., ... & Higuchi, M. (2021). Dynamic alterations in the central glutamatergic status following food and glucose intake: in vivo multimodal assessments in humans and animal models. Journal of Cerebral Blood Flow & Metabolism, 41(11), 2928-2943.
2020
Orlova, N., Najafi, F., Tsyboulski, D., Seid, S., Kivikas, S., Kato, I., ... & Lecoq, J. (2020). Multiplane Mesoscope reveals distinct cortical interactions following expectation violations. bioRxiv, 2020-10.
Froudarakis, E., Cohen, U., Diamantaki, M., Walker, E. Y., Reimer, J., Berens, P., ... & Tolias, A. S. (2020). Object manifold geometry across the mouse cortical visual hierarchy. bioRxiv, 2020-08.
2018
Tsyboulski, D., Orlova, N., Lecoq, J., & Saggau, P. (2018). MesoScope Upgrade: Dual Plane Remote Focusing Imaging System for Recording of Ca2+ Signals in Neural Ensembles. Biophotonics Congress: Biomedical Optics Congress 2018 (Microscopy/Translational/Brain/OTS), OSA Technical Digest, JW3A.60.
2017
Lu, R., Sun, W., Liang, Y., Kerlin, A., Bierfeld, J., Seelig, J. D., ... & Ji, N. (2017). Video-rate volumetric functional imaging of the brain at synaptic resolution. Nature Neuroscience, 20(4), 620-628.
2016
Sofroniew, N.J., Flickinger, D., King, J., & Svoboda, K. (2016). A large field of view two-photon mesoscope with subcellular resolution for in vivo imaging. eLife, 5, e14472.
| Posted Comments: | |
CHI LIU
(posted 2021-03-31 11:16:09.39) Hello, is it possible to buy the objective alone? YLohia
(posted 2021-03-31 11:24:23.0) Hello, we will reach out to you directly. gregory.gauvain
(posted 2017-05-30 17:01:41.7) Hello,
is it possible to buy the objective alone?
Thanks.
Gregory nbayconich
(posted 2017-06-13 04:58:47.0) Thank you for contacting Thorlabs. At the moment we are only selling the Multiphoton Mesoscope as a whole system. I will contact you directly with more information. heuckerothr
(posted 2017-05-02 18:31:31.16) I recognize that the multiphoton mesoscope is a new device. Any idea what it will cost?
Thanks.
Robert O. Heuckeroth tfrisch
(posted 2017-05-03 11:21:07.0) Hello, thank you for contacting Thorlabs. I have asked a Sales Representative to reach out to you with information about a quote. |
 Products Home
Products Home



















 2光子メゾスコープ
2光子メゾスコープ