レーザ走査型顕微鏡のチュートリアル


Please Wait
レー ザ走査型顕微鏡(LSM)チュートリアルレー ザ走査型顕微鏡(LSM)は生物科学において欠かすことのできないイメージングツールです。本チュートリアルでは、共焦点蛍光イメージング、多光子励起蛍光イメージングについて説明し、第2、第3高調波発生イメージング技術をご紹介します。ここでは、当社のイメージングツールの背景にある技術に焦点を当てるとともに、生体試料の点走査について記します。 |
はじめに
顕微鏡の目標は、高コントラスト、高分解能の画像を作成することです。望遠鏡を使用することで宇宙を細部に至るまで観測可能になったのと同じように、顕微鏡によりナノメートルのスケールで生体機能を観察することが可能になりました。近年のレーザ走査型顕微鏡は多次元のデータ(X, Y, Z, τ, λ)を取得することができます。この多次元のデータによって、基本的な生体プロセスの理解を促進させる大量の高分解能イメージングが可能になります。
市販の広視野顕微鏡(図1)では、薄い試料(厚さが細胞層1つまたは2つ程度)でなければ、高品質な画像が取得できません。しかし、多くの用途では、厚さのある試料のイメージングが必要で、指定の試料焦点面内からの体積データセット取得やデータ選択が求められます。市販の広視野顕微鏡ではこれらのニーズに対応できません。
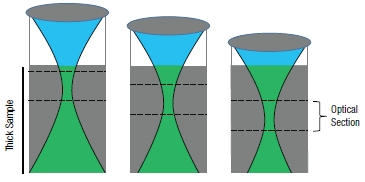
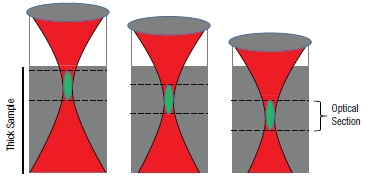
LSM、特に共焦点レーザ走査型顕微鏡や 多光子レーザ走査型顕微鏡は厚みのあるバルク試料内部のごく薄い面を可視化できます。これはオプティカルセクショニング(光断層像)として知られています。共焦点LSMでは、試料の光焦点外からの信号は開口によって物理的にブロックされ、検出されません。後に記しますが、多光子LSMでは、焦点面外からほとんど信号が発生しません。図2のように焦点を徐々に変えてオプティカルセクショニングを組み合わせることで、レーザ走査型顕微鏡技術は厚い試料の3次元画像を作り出します。
図1 ワイドフィールド落射蛍光顕微鏡 |
図2 光学断面(バルク試料内の薄膜の可視化)共焦点顕微鏡の光学断面 多光子顕微鏡の光学断面 試料から発生した信号は緑色で示されています。光学断面は特定の焦点面内で発生した信号を識別して計測することで形成されます。共焦点 LSMでは、焦点外からの光はピンホールを使用することで除去されるため、高分解能が達成されます。一方、多光子顕微鏡では、信号光は焦点体積内でのみ発 生します。それぞれの光学断面で収集された信号光は 3 次元画像を作り出すために再構成されます。 |
LSM におけるコントラストメカニズム
一般的に生物試料のコントラストはあまりよくないため、隣接する構造間の境界を観察するのは難しくなります。レーザ走査型顕微鏡においてコントラストを 改善する一般的な方法として蛍光が使用されます。
蛍光では、光を放出する分子を利用して、観察対象を背景や隣接する構造と区別します。この光を放出する分子は、もともと試料内に存在する場合内因性、もしくは自家蛍光)、外部から標識として構成物質に付加される場合(化学的に、もしくは抗体結合を通して)、あるいは蛍光タンパク質のように細胞内に導入される場合があります。
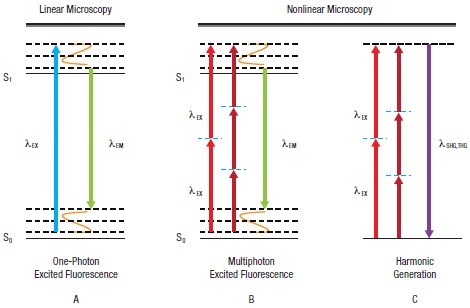
蛍光分子から光を放出させる(蛍光を発生させる)には、図3Aに示されるように、まずは分子が基底状態から励起状態に遷移できるように、適度なエネルギ量をもつ光(1つの光子)を吸収しなければなりません。蛍光 は分子が励起状態から基底状態に落ちるときに放出されます。蛍光量は入射レーザ強度(I)に比例します。このような理由で、共焦点LSMは、しばしば線形イメージング技術と呼ばれています。緩和過程での自然損失により、放出された光は、吸収された光のエネルギより低いエネルギ(すなわち、長波長)になります。
分子の多光子励起(MPE、図3B)は、2つ以上の光子が同時に到着し、そのエネルギの合計が分子の遷移エネルギを満たしたときに起こります。つまり、到着した2つの光子は、放出された蛍光の光子よりも低いエネルギを有するわけです。
多光子技術には、光子の非吸収過程を使う技術もあります。高調波発生(HG)が生じる状態では、図3Cに描かれているように、複数の入射光子が同時に消滅して、入射光子の合計エネルギと等しいエネルギを持つ新しい光子が1つ生成されます。
さらに高調波の次数を物理的に観測することで、試料の成分識別が可能となります。第2高調波発生(SHG)の場合、構成物質の規則性が高く、非反転対称であるときに信号が発生します。第3高調波発生(THG)は、屈折率変化のある境界界面で観測されます。2光子励起とSHGは非線形過程であり、信号は入射光強度の2乗(I 2)に依存して発生します。
多光子顕微鏡において、非線形性の信号発生を観測する為に高い光子密度が必要です。この条件を満たしながら、試料上の平均強度を比較的低く保つためには、モード同期フェムト秒パルスレーザ、特にTi:サファイアレーザが一般的に使用されます。
非線形光学顕微鏡でもう1つ考慮するべきことは、特定の蛍光体の励起波長です。理想的な励起波長は 1光子吸収のピーク波長の2倍と考えられがちですが、ほとんどの蛍光体において、励起状態の選択則は1光子吸収と2光子吸収で異なります。
このことから、2光子吸収スペクトルと1光子吸収スペクトルは大きく異なっています。1光子吸収スペクトルと比較し て、2光子吸収スペクトルはしばしば非常に広帯域(>100 nm)となりますが、なめらかな準ガウス曲線にはなりません。2光子吸収スペクトルは多 くの蛍光体において広帯域であるため、1つのレーザで複数の蛍光分子の励起が可能で、複数の対象構成物質が同時に観察できます。
励起される全ての蛍光体が 同じ励起ピークを持っている必要はありませんが、それぞれの励起範囲の間で重複した領域が必要です。複数の蛍光体を励起する一般的な方法としては、全ての 蛍光体を許容される効率で励起できる波長を選択します。
図3 レーザ走査型顕微鏡における信号光発生光子の吸収を伴うプロセス(A、B): 1つ以上の励起光子(λEX)の吸収により、分子が基底準位 (S0) から励起準位(S1)に遷移します。分子が基底準位にもどるときに、蛍光 (λEM) が放出されます。 光子の吸収を伴わないプロセス(C): 複数の励起光子(λEX)が、同時に励起光子のエネルギの合計と同じエネルギを持つ1つの光子 (λSHG,THG)に変換されます。波長は1/2 (SHG) または1/3 (THG)の波長に変換されます。
|
画像形成
点走査LSMにおいて、1つの平面画像は、点照明光源を試料上に回折限界スポットまで結像し、その後ポイントディテクタ上に結像することで形成されます。2次元のen face画像は、回折限界スポットを試料上で1点ずつ走査してラインを形成し、さらにラインからラインへラスタ式に走査することで形成されます。
照射された体積領域から信号を発し、単一素子のディテクタ上に結像されます。最も一般的に使用される単一素子ディテクタは光電子増倍管(PMT)ですが、アバランシェフォトダイオード(APD)が使用される場合もあります。CCDカメラは一般的に点走査型顕微鏡には使用しませんが、多焦点(つまりスピニングディスク共焦点)用途でディテクタとして使用されることがあります。
ディテクタからの信号はコンピュータに伝送され、試料全体にわたって走査した各点からの強度信号の配列として2次元画像が形成されます。LSMでは実像が形成されるわけではないので、デジタルイメージング技術と言われています。単一点走査と単一点検出の利点は、表示される画像分解能、光学分解能、そして走査領域が、システムのイメージング用光学素子によって予め決められることなく、個々の実験の要件に合わせて設定できることです。
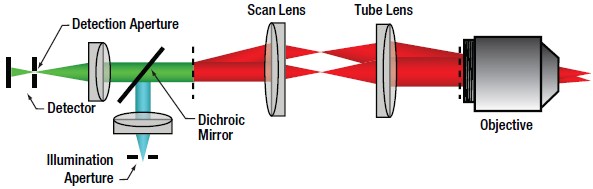
図4 共焦点顕微鏡の光路
|
共焦点LSM
共焦点LSMでは点照明光源(一般的にはシングルモードファイバ出力CWレーザ)が、オプティカルセクショニングを可能にする重要な決め手となります。シングルモードファイバのコアから出射される光はコリメートされ、走査用の照明ビームとして使用されます。走査系は対物レンズの後方開口にビームを導きます。対物レンズを通した走査ビームは試料上に回折限界まで集光されます。集光された照明ビームにより発生した信号は対物レンズを遡って収集され、走査系を通過します。
走査系を通過した信号はダイクロイックミラーにより照明光ビームと分離され、レンズで集光されます。焦点位置に共焦点ピンホールが置かれます。この配置により、焦点面の前後で発生する光はピンホールによってブロックされ、オプティカルセクショニング画像が作られます(上の図2参照)。ディテクタは図4の通り共焦点ピンホールの後ろに置かれます。ピンホールサイズは共焦点顕微鏡のイメージングの質(特に、コントラスト、分解能、オプティカルセクショニングの厚さ)に直接影響します。
共焦点顕微鏡の横方向分解能は、試料上で回折限界スポットを作り出すシステムの能力によります。回折限界のスポットは、レーザービーム、走査用光学素子、対物レンズの品質に依存します。
ビーム品質は一般的にシングルモードファイバを使用することで保証されます。シングルモードファイバで伝送される励起用レーザ光はガウス分布の点光源となり、コリメート後回折限界まで集光できます。最高品質の光学素子を使用することで得られる収差のないイメージングシステムにおいて、均一照明を仮定した場合の集光スポットのサイズは、式1のように励起波長(λEX)と対物レンズの開口数(NA)によります。
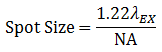
式1 スポットのサイズ
実際には、ビームは本当の点には集光されず、むしろエアリーパターンと呼ばれる同心円環状の形状になります。スポットサイズはエアリーディスクの直径(エアリーパターンの第1暗環の中心を通る直径)であり、1エアリーユニット(AU)と呼ばれています。これは後にピンホールのサイズについて議論するときに重要になります。
イメージングシステムの横方向の分解能は、2つの点を完全に区別できる最小の距離と定義されています。共焦点(ならびに多光子)LSMにおいて横方向分解能は、観測できる個々の点のFWHM(Full Width at Half Maximum、半値全幅)により定義するのが一般的で実験用途でも便利です。
FWHMの定義を使用した共焦点LSMにおける横方向分解能(Rlateral,confocal)は:
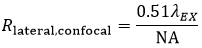
式2 共焦点LSMの横方向分解能
そして軸方向分解能(Raxial,confocal)は下記の式で表します。
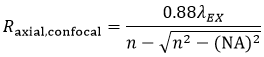
式3 共焦点LSMの軸方向分解能
ここで、nは液侵媒質の屈折率です。
興味深い点は、共焦点顕微鏡において横方向分解能は単に励起波長で決定されるということです。これに対して、広視野顕微鏡の横方向分解能は発光波長だけで決定されます。
適切な共焦点ピンホールのサイズは、励起光のスポットサイズに顕微鏡の総合倍率を乗じることにより求められます:
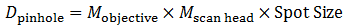
式4 ピンホールの直径
例えばλEX = 488 nm、NA=1.0の60倍対物レンズに適したピンホールのサイズは38.2 µm(当社の共焦点走査ヘッドMscan head = 1.07)で、直径1AUのピンホールと呼ばれます。対物レンズのパラメータはそのままで、倍率だけを40倍に変更した場合、適切なピンホールのサイズは25.5 µmとなり、これもまた直径1AUのピンホールと呼ばれます。よってたとえ2つの異なる対物レンズに応じてピンホールの選択を変える必要がでても、AUを単位としてピンホールの直径を定義することはピンホールの直径を規格化する手法です。
理論的に、共焦点顕微鏡のトータル分解能は、励起光のスポットサイズとディテクタ側のピンホールのサイズにより決まります。これは、ピンホールのサイズを小さくすることで光学系の分解能が改善されることを示しています。現実的には、ピンホール径を小さくすると、分解能と共焦点性が向上する一方で、ディテクタで検出される信号は減少します。1AUのピンホールは信号の強さ、分解能、共焦点性のバランスに優れています。
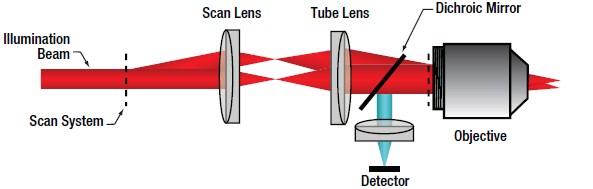
図5 多光子型レーザ走査型顕微鏡の光路
|
多光子 LSM
多光子LSMの場合、短パルスの自由空間レーザ光源から出射されたコリメート光が走査系を通過し、対物レンズで集光されます。信号が入射強度の2乗(I2)に依存するので、多光子吸収の発生確率は非常に低く、信号の発生領域は対物レンズの焦点面に限られます。したがって、焦点面の前後では信号がほとんど発生しません。この焦点以外から発生する信号の効果的な除去により、共焦点ピンホールがなくてもオプティカルセクショニングが可能になります(上の図2参照)。この構成の結果、信号は走査系に戻る必要がなくなるので、ディテクタを図5の通り対物レンズのできるだけ近くに配置し、信号の収集効率を最大にすることが可能です。走査系を遡る前の信号を収集するディテクタは、ノンデスキャンディテクタと呼ばれています。
再びFWHMの定義を使用した多光子LSMにおける横方向分解能(Rlateral,multiphoton)は下記の通り表します:
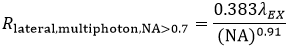
式5 多光子LSMの横方向分解能
そして軸方向分解能(Raxial,multiphoton)は次式の通りです:
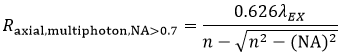
式6 多光子LSMの軸方向分解能
上の式では対物レンズNAを、実質すべての多光子顕微鏡対物レンズに該当する>0.7と仮定しています。
多光子励起波長を長くすると、多光子LSMにおける分解能(式5)は共焦点LSMに比べて約2倍低下することになります。ある理想的な点状物体(例えば、分解能以下のサイズの蛍光ビーズ)に対しては、信号がI2依存性を有するため、集光された照明スポットサイズが2倍増加することを打ち消す以上に、有効焦点体積を減少させます。
横方向、軸方向分解能は強度依存性を持つということに注意する必要があります。レーザのパワーが増加するにつれ回折限界の焦点体積内で信号の発生確率は増加します。実際には、多光子顕微鏡の横方向分解能は、どれだけ照明ビームを小さく集光できるかで制限され、適度な強度であれば式5によって近似されます。軸方向分解能は励起光強度が増加するにつれ低下します。
画面表示
画像を直接にレンダリングしないとしても、画像フィールドの大きさ、スクリーン上で画像を表示しているピクセル数(取得画像の解像度)、およびイメージングシステムの横方向分解能について考慮するこ とは重要です。鉛直面en-face画像をレンダリングしているので、横方向の分解能を用います。光学系が分解できる画像の最良の形状を、正確に表示する ためには、走査領域と分解能(解像度と横方向分解能)がうまく釣り合うようにしなければいけません。それゆえ、解像度は、光学分解能に適している必要があります。
LSM では、一般的にナイキストのサンプリング定理に従い、ピクセルサイズは横方向分解能を2.3で割った値にするべきです。これは、前出の60倍対物レンズを 考えた場合、横方向分解能は249 nm となり(式2)、表示される画像のピクセルサイズは約108 nm程度にするべきだということを意味します。この結果、解像度が1024 × 1024ピクセルの場合、試料上の走査領域は約111 μm x 111 μmとなります。なお、前出の例の40倍対物レンズの場合でも、試料内の走査領域は全く同じになります(両方の対物レンズは同じNAです)。2つの画像の間の唯一の違いは、画像を取得するときのスキャナの傾き角です。
画像をこのような高分解能で取得する必要がない場合もあると思われま す。画像における信号光、試料の寿命、分解能のバランスをとるためには、画像分解能、走査領域、解像度のトレードオフの関係を常に意識する必要があります。
生体細胞のイメージングについて
LSM の重要な特性の1つは、生きている細胞と組織をイメージングすることができることです。しかし残念ながら、蛍光プロセスの副産物の一部は細胞毒性をもちえます。そのため、高品質の画像を取得することと、細胞を生かし続けることの間には繊細なバランスが存在します。
考慮すべき重要なことの1つは蛍光色素分子 の飽和です。飽和状態とは、レーザ強度を大きくしても蛍光強度が同時に大きくならない状態です。この現象は、蛍光色素分子のわずか10%しか励起状態にな いときにも起こりえます。
飽和状態が起こる原因は、1度励起された蛍光色素分子が緩和して基底状態に戻るために必要とされる時間の長さにあります。蛍光の 過程は比較的速いのですが(数百 ps ~数 ns)、これは緩和機構の1つにすぎません。3重項遷移や無輻射遷移はかなり長い緩和時間を必要とします。さらに、基底状態に緩和して戻る前に蛍光色素分子を再励起すると、蛍光色素分子の不可逆的な退色が引き起こされます。退色がゆっくりと発生する場合、細胞は、蛍光に起因する細胞毒性を本質的な機構として有しています。
退色とそれに付随する細胞毒性を低減させる1つの方法は高速走査です。画像の1点に使用するレーザの照射時間を減らすと、それに比例して検出される信号光が減少しますが、一部の褪色機構も抑えられます。これはレーザ光がその地点に戻る前に、蛍光色素分子が完全に基底状態に緩和して戻るためです。最高速度が重要な課題でない場合、数本のラインまたは数個のフレーム全体を平均化することで、短い積算時間で消失した信号光を作り出すことができます。
多光子LSMの長い励起波長と、ノンデスキャン検出能力により、生体試料の深部までイメージングすることができます。散乱は波長の4乗に反比例 するので、長波長になるほど試料による散乱の影響は少なくなります。一般的な浸透深さは 250~500 μm程度ですが、論文によると、共焦点顕微鏡が100 μm程度の深度であるのに対して多光子LSMでは1 mmの深度のイメージングが報告されています。
当社では、用途ごとのさまざまなご要望にお応えできるように、
お客様のニーズに合わせたご提案を心掛けていきたいと考えています。
ご意見・ご要望、またご質問などございましたら当社までお気軽にご連絡ください。
| Posted Comments: | |
Sylvie Le Guyader
(posted 2024-02-26 08:46:57.293) Hello
In this information webpage (https://www.thorlabs.com/newgrouppage9.cfm?objectgroup_id=10765), you state the equations for the resolution (axial and lateral) of a multiphoton system. Would you have a reference for these equations? What are the equations if the objective NA is higher than 0.7?
Thanks
Sylvie Le Guyader |
 Products Home
Products Home


 レーザ走査型顕微鏡
レーザ走査型顕微鏡